![]() a. ¿Qué es el calor latente de una sustancia?
¿y el calor específico?
a. ¿Qué es el calor latente de una sustancia?
¿y el calor específico?
b. ¿Es posible transformar todo el calor en trabajo en un ciclo? Razona la respuesta.
c. ¿En qué casos se mantiene constante la temperatura de un cuerpo al que suministramos calor?
![]() En un vaso de cobre, que pesa 1.5 kg, contiene un
bloque de hielo de 10 kg a la temperatura de -10 ºC, se inyecta 5 kg de vapor de agua a
100 ºC.
En un vaso de cobre, que pesa 1.5 kg, contiene un
bloque de hielo de 10 kg a la temperatura de -10 ºC, se inyecta 5 kg de vapor de agua a
100 ºC.
Calor específico del cobre 397 J/kg ºK. Calor de fusión del hielo 334 400 J/kg. Calor específico del agua 4180 J/kg ºK. Calor específico del hielo 2090 J/kg ºK.Calor de licuefación del vapor del agua 2 257 200 J/kg.
![]() Un trozo de hielo de 583 cm3 a 0 ºC se
calienta y se convierte en agua a 4 ºC. Calcular el incremento de energía interna y
entropía que ha experimentado.
Un trozo de hielo de 583 cm3 a 0 ºC se
calienta y se convierte en agua a 4 ºC. Calcular el incremento de energía interna y
entropía que ha experimentado.
Datos: densidad del hielo 0.917 gr/cm3, del agua 1 gr/cm3, calor de fusión del hielo 80 cal/g.
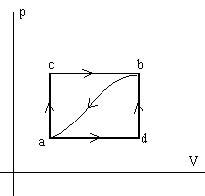 |
Cuando un sistema pasa del estado a al b a lo largo de la transformación acb recibe una cantidad de calor de 20000 cal y realiza 7.500 cal de trabajo. |
Nota: no hace falta ningún dato de p y V para resolver el problema
![]() Consideremos helio (gas perfecto monoatómico cv=3R/2) en el estado inicial A: PA=105
Pa, VA=10-2 m3 y TA=300
K. Se llevan a cabo las siguientes transformaciones:
Consideremos helio (gas perfecto monoatómico cv=3R/2) en el estado inicial A: PA=105
Pa, VA=10-2 m3 y TA=300
K. Se llevan a cabo las siguientes transformaciones:
A ® B: Transformación isoterma reversible siendo VB=2 10-2 m3
B ® C: Transformación isócora (V=cte) reversible siendo TC=189 K
C ® A: Transformación adiabática reversible, que devuelve al gas a sus condiciones iniciales.
a) Determinar el número de moles de helio, confeccionar una tabla en la que aparezcan los valores P, V y T en los tres estados A, B y C, y dibujar el ciclo en el diagrama P-V.
b) Calcular, en unidades del sistema internacional, de forma directa (siempre que sea posible) el trabajo W, el calor Q, y la variación de energía interna DU, del gas para cada uno de los procesos.
c) Determinar el rendimiento de este ciclo como motor térmico y comparar el resultado con el de un motor de Carnot que funcione entre las dos temperaturas extremas del ciclo.
Dato: R=8.33 J/(mol K)
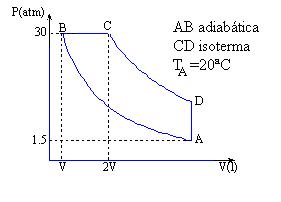 |
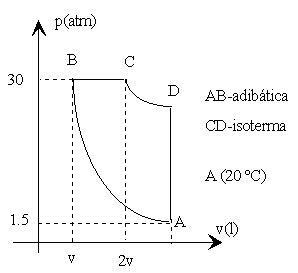
Una máquina térmica trabaja con 3 moles de un gas monoatómico, describiendo el ciclo reversible ABCD de la figura. Sabiendo que VC = 2 VB:
|
R=0.082 atm l/mol K; 1cal=4.186J; 1atm=1.013 105 Pa, cv=3R/2
![]() 10 moles de un gas diatómico (Cv=5R/2) se
encuentran inicialmente a una presión de PA = 5 105 Pa y ocupando
un volumen de VA = 249 10-3 m3. Se expande
adiabáticamente (proceso AB) hasta ocupar un volumen VB = 479 10-3
m3. A continuación el gas experimenta una transformación isoterma (proceso
BC) hasta una presión PC = 1 105 Pa. Posteriormente se comprime
isobáricamente (proceso CD) hasta un volumen VD = VA = 249 10-3
m3. Por último, experimenta una transformación a volumen constante (proceso
DA) que le devuelve al estado inicial.
10 moles de un gas diatómico (Cv=5R/2) se
encuentran inicialmente a una presión de PA = 5 105 Pa y ocupando
un volumen de VA = 249 10-3 m3. Se expande
adiabáticamente (proceso AB) hasta ocupar un volumen VB = 479 10-3
m3. A continuación el gas experimenta una transformación isoterma (proceso
BC) hasta una presión PC = 1 105 Pa. Posteriormente se comprime
isobáricamente (proceso CD) hasta un volumen VD = VA = 249 10-3
m3. Por último, experimenta una transformación a volumen constante (proceso
DA) que le devuelve al estado inicial.
R= 0.082 atm l/(mol K) = 8.314 J/(mol K) ; 1 cal = 4.186 J; 1atm = 1.013 105 Pa
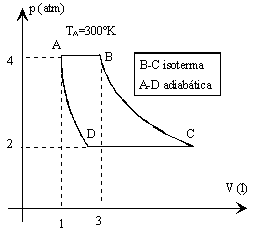 |
En el ciclo de la figura que describe un gas ideal monoatómico
R=0.082 atm l/(ºK mol) 1 cal= 4.186 J. 1 atm = 1.013 105 Pa |
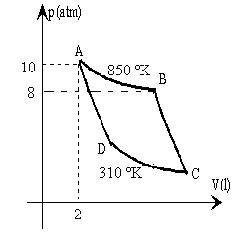 |
Un gas diatómico, cv=5R/2, describe el ciclo de Carnot de la
figura. Las transformaciones A-B y C-D son isotermas y las transformaciones B-C y D-A son
adiabáticas.
Dato: R=8.314 J/(ºK mol)=0.082 atm.l/(ºK mol) |
 |
Una máquina térmica trabaja sobre 3 moles de un gas monoatómico,
realizando el ciclo reversible ABCD de la figura. Si el volumen del gas en el estado C es
el doble del volumen del gas en el estado B.
|